Cos'è l'estrazione del rame?

L'estrazione del rame si riferisce ai metodi utilizzati per ottenere il rame dai suoi minerali. La conversione del rame consiste in una serie di processi fisici ed elettrochimici. I metodi si sono evoluti e variano a seconda del paese a seconda della fonte del minerale, delle normative ambientali locali e di altri fattori.
Come in tutte le operazioni minerarie, il minerale deve essere solitamente arricchito (concentrato). Le tecniche di lavorazione dipendono dalla natura del minerale. Se il minerale è principalmente minerali di rame solfuro (come la calcopirite), il minerale viene frantumato e macinato per liberare i minerali preziosi dai minerali di scarto ("gangue"). Viene quindi concentrato mediante flottazione minerale. Il concentrato viene in genere poi venduto a fonderie lontane, sebbene alcune grandi miniere abbiano fonderie situate nelle vicinanze. Tale collocazione di miniere e fonderie era più tipica nel XIX e all'inizio del XX secolo, quando le fonderie più piccole potevano essere economiche. I concentrati di solfuro vengono tipicamente fusi in forni come il forno flash Outokumpu o Inco o il forno ISASMELT per produrre opachi, che devono essere convertiti e raffinati per produrre rame anodico. Infine, il processo di raffinazione finale è l'elettrolisi. Per ragioni economiche e ambientali, molti dei sottoprodotti dell'estrazione vengono bonificati. Il gas di anidride solforosa, ad esempio, viene catturato e trasformato in acido solforico, che può quindi essere utilizzato nel processo di estrazione o venduto per scopi come la produzione di fertilizzanti.
I minerali di rame ossidati possono essere trattati mediante estrazione idrometallurgica.
Storia

Minatori presso la miniera di Tamarack a Copper Country, nel 1905
La prima prova della martellatura a freddo del rame nativo proviene dallo scavo di Çayönü Tepesi nell'Anatolia orientale, che risale tra il 7200 e il 6600 a.C. [1] Tra i vari oggetti considerati votivi o amuleti ce n'era uno che sembrava un amo e uno come un punteruolo. Un altro ritrovamento, nella grotta di Shanidar a Mergasur, in Iraq, conteneva perline di rame, risalenti all'8.700 a.C. [2]
Una delle più antiche miniere di rame conosciute al mondo, al contrario dell'uso di depositi superficiali, si trova nella valle di Timna, in Israele, dal quarto millennio aC, con l'utilizzo di depositi superficiali dal sesto al quinto millennio. [3] [4]
Il sito archeologico di Pločnik nell'Europa sud-orientale (Serbia) contiene la più antica prova datata con sicurezza [ dubbiosa – discuti ] della produzione di rame ad alta temperatura, dal 5.000 a.C. La scoperta nel giugno 2010 estende per ulteriori 500 anni il precedente record di fusione del rame da Rudna Glava (Serbia), datato al V millennio a.C. [5]
La tecnologia di fusione del rame ha dato origine all'età del rame, alias età calcolitica, e poi all'età del bronzo. L'età del bronzo non sarebbe stata possibile senza che gli esseri umani sviluppassero la tecnologia di fusione.
Concentrazione
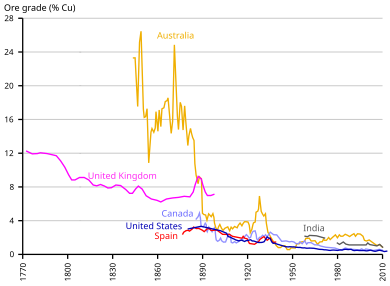
La diminuzione della concentrazione di rame nei minerali richiede ora il pretrattamento dei minerali.
La maggior parte dei minerali di rame contiene solo una piccola percentuale di rame metallico legato all'interno di minerali preziosi, mentre il resto del minerale è costituito da rocce o gangheminerali indesiderati, tipicamente minerali di silicato o minerali di ossido per i quali spesso non c'è valore. In alcuni casi, gli sterili sono stati ritirati per recuperare il valore perso poiché la tecnologia per il recupero del rame è migliorata. Il grado medio dei minerali di rame nel 21 ° secolo è inferiore allo 0,6% di rame, con una percentuale di minerali economici (compreso il rame) inferiore al 2% del volume totale della roccia minerale. Un obiettivo chiave nel trattamento metallurgico di qualsiasi minerale è la separazione dei minerali minerali dai minerali della ganga all'interno della roccia.
La prima fase di qualsiasi processo all'interno di un circuito di trattamento metallurgico è l'accurata macinazione o frantumazione , in cui la roccia viene frantumata per produrre piccole particelle (<100 μm) costituite da singole fasi minerali. Queste particelle vengono quindi separate per rimuovere la ganga (residui rocciosi), quindi segue un processo di liberazione fisica dei minerali minerali dalla roccia. Il processo di liberazione dei minerali di rame dipende dal fatto che siano minerali di ossido o solfuro. [6]
I passaggi successivi dipendono dalla natura del minerale contenente il rame e da cosa verrà estratto. Per i minerali di ossido, viene normalmente intrapreso un processo di liberazione idrometallurgica, che utilizza la natura solubile dei minerali minerali a vantaggio dell'impianto di trattamento metallurgico. Per i minerali di solfuro, sia secondari (supergene) che primari (ipogene), la flottazione con schiuma viene utilizzata per separare fisicamente il minerale dalla ganga. Per corpi minerali speciali contenenti rame nativo o sezioni di corpi minerali ricchi di rame nativo supergene, questo minerale può essere recuperato mediante un semplice circuito a gravità.
Flottazione della schiuma

Celle di flottazione della schiuma per concentrare minerali di solfuro di rame e nichel, Falconbridge, Ontario.
Il moderno processo di flottazione con schiuma è stato inventato indipendentemente all'inizio del 1900 in Australia da CV Potter e più o meno nello stesso periodo da GD Delprat. [7]

Bolle d'aria caricate con solfuro di rame su una cella Jameson presso l'impianto di flottazione della Prominent Hillmine nell'Australia meridionale
Tutti i minerali di solfuro primari di solfuri di rame e la maggior parte dei concentrati di solfuri di rame secondari (essendo calcocite) sono soggetti a fusione. Esistono alcuni processi di lisciviazione in vasca o lisciviazione a pressione per solubilizzare i concentrati di calcocite e produrre catodo di rame dalla soluzione di percolato risultante, ma questa è una parte minore del mercato.
I concentrati di carbonato sono un prodotto relativamente minore prodotto da impianti di cementazione del rame, tipicamente come fase finale di un'operazione di lisciviazione di cumuli. Tali concentrati di carbonato possono essere trattati mediante un impianto di estrazione con solvente ed elettroestrazione (SX-EW) o fusi.
Il minerale di rame viene frantumato e macinato a una dimensione tale che si è verificato un grado di liberazione accettabilmente elevato tra i minerali del minerale di solfuro di rame ei minerali della ganga. Il minerale viene quindi bagnato, sospeso in un impasto liquido e miscelato con xantati o altri reagenti, che rendono idrofobiche le particelle di solfuro. I reagenti tipici includono l'etilxantato di potassio e l'etilxantato di sodio, ma vengono utilizzati anche ditiofosfati e ditiocarbammati.
Il minerale trattato viene introdotto in un serbatoio di aerazione riempito d'acqua contenente tensioattivo come il metilisobutil carbinolo (MIBC). L'aria viene costantemente forzata attraverso l'impasto liquido e le bolle d'aria si attaccano alle particelle idrofobe di solfuro di rame, che vengono condotte in superficie, dove formano una schiuma e vengono eliminate. Queste scremature sono generalmente sottoposte a una cellula detergente-scavenger per rimuovere i silicati in eccesso e per rimuovere altri minerali di solfuro che possono influire negativamente sulla qualità del concentrato (tipicamente, galena) e il concentrato finale inviato alla fusione. La roccia che non si è staccata dalla cella di flottazione viene scartata come residuo o ulteriormente lavorata per estrarre altri metalli come piombo (dalla galena) e zinco (dalla sfalerite), se esistenti. Per migliorare l'efficienza del processo, la calce viene utilizzata per aumentare il pH del bagnomaria, facendo sì che il collettore si ionizzi maggiormente e si leghi preferenzialmente alla calcopirite (CuFeS 2) ed eviti la pirite (FeS 2). Il ferro esiste in entrambi i minerali della zona primaria. I minerali di rame contenenti calcopirite possono essere concentrati per produrre un concentrato con tra il 20% e il 30% di rame in concentrato (di solito 27-29% di rame); il resto del concentrato è ferro e zolfo nella calcopirite e impurità indesiderate come i minerali della ganga di silicato o altri minerali solfuri, tipicamente quantità minori di pirite, sfalerite o galena. I concentrati di calcocite in genere si classificano tra il 37% e il 40% di rame-in-concentrato, poiché la calcocite non ha ferro all'interno del minerale.
Estrazione idrometallurgica
Minerali di solfuro
I solfuri secondari - quelli formati dall'arricchimento secondario del supergene - sono resistenti ( refrattari ) alla lisciviazione solforica. Questi minerali sono una miscela di carbonato di rame, solfato, fosfato e minerali di ossido e minerali di solfuro secondari, prevalentemente calcocite ma altri minerali come la digenite possono essere importanti in alcuni depositi.
I minerali supergene ricchi di solfuri possono essere concentrati utilizzando la flottazione con schiuma. Un tipico concentrato di calcocite può classificare tra il 37% e il 40% di rame nel solfuro, rendendoli relativamente economici da annusare rispetto ai concentrati di calcopirite.
Alcuni depositi di solfuro di supergene possono essere lisciviati utilizzando un processo di lisciviazione del cumulo di ossidazione batterica per ossidare i solfuri in acido solforico, che consente anche la lisciviazione simultanea con acido solforico per produrre una soluzione di solfato di rame. Come per i minerali di ossido, per recuperare il rame dalla soluzione di lisciviazione gravida vengono utilizzate tecnologie di estrazione con solvente e di estrazione elettronica.
I minerali di solfuro di supergene ricchi di minerali di rame nativi sono refrattari al trattamento con lisciviazione di acido solforico su tutte le scale temporali praticabili e le particelle metalliche dense non reagiscono con i mezzi di flottazione della schiuma. In genere, se il rame nativo è una parte minore di un profilo di supergene, non verrà recuperato e riporterà agli sterili. Quando sono sufficientemente ricchi, i corpi di minerali di rame nativi possono essere trattati per recuperare il rame contenuto tramite un circuito di separazione per gravità in cui la densità del metallo viene utilizzata per liberarlo dai minerali di silicato più leggeri. Spesso, la natura della ganga è importante, poiché i minerali di rame nativi ricchi di argilla si rivelano difficili da liberare.
Minerali di ossido
I corpi di minerale di rame ossidato possono essere trattati tramite diversi processi, con processi idrometallurgici utilizzati per trattare i minerali di ossido dominati da minerali di carbonato di rame come azzurrite e malachite e altri minerali solubili come silicati come la crisocolla o solfati come l'atacamite e così via.
Tali minerali di ossido vengono solitamente lisciviati dall'acido solforico, di solito in un processo di lisciviazione di cumuli o discarica per liberare i minerali di rame in una soluzione di acido solforico carica di solfato di rame in soluzione. La soluzione di solfato di rame (la soluzione di lisciviazione incinta) viene quindi spogliata del rame tramite un impianto di estrazione con solvente e di estrazione elettronica (SX-EW), con l'acido solforico barrato (denudato) riciclato di nuovo nei cumuli. In alternativa, il rame può essere precipitato fuori dalla soluzione gravida mettendolo a contatto con rottami di ferro; un processo chiamato cementazione. Il rame cementizio è normalmente meno puro del rame SX-EW. Comunemente l'acido solforico è usato come lisciviante per l'ossido di rame, sebbene sia possibile utilizzare l'acqua, in particolare per i minerali ricchi di minerali solfati ultrasolubili. [ citazione necessaria ]
In generale, la flottazione con schiuma non viene utilizzata per concentrare i minerali di ossido di rame, poiché i minerali di ossido non rispondono alle sostanze chimiche o al processo di flottazione della schiuma (cioè non si legano alle sostanze chimiche a base di cherosene). I minerali di ossido di rame sono stati occasionalmente trattati tramite flottazione con schiuma tramite solforazione dei minerali di ossido con alcune sostanze chimiche che reagiscono con le particelle di minerali di ossido per produrre una sottile brina di solfuro (solitamente calcocite), che può quindi essere attivata dall'impianto di flottazione con schiuma.
Fusione del solfuro
Fino alla seconda metà del 20° secolo, la fusione dei minerali di solfuro era quasi l'unico mezzo per produrre rame metallico dai minerali estratti ( produzione primaria di rame). Davenport, et al, hanno notato nel 2002 che anche allora l'80% della produzione mondiale di rame primario proveniva da minerali rame-ferro-zolfo e che la stragrande maggioranza di questi era trattata mediante fusione.
Il rame è stato inizialmente recuperato dai minerali di solfuro mediante la fusione diretta del minerale in una fornace. [9] Le fonderie erano inizialmente ubicate vicino alle miniere per ridurre al minimo i costi di trasporto. Ciò ha evitato i costi proibitivi del trasporto dei minerali di scarto e dello zolfo e del ferro presenti nei minerali contenenti rame. Tuttavia, poiché la concentrazione di rame nei corpi minerari è diminuita, anche i costi energetici della fusione dell'intero minerale sono diventati proibitivi ed è diventato necessario concentrare prima i minerali.
Le tecniche di concentrazione iniziale includevano lo smistamento manuale [10] e la concentrazione per gravità. Hanno provocato elevate perdite di rame. Di conseguenza, lo sviluppo del processo di flottazione con schiuma è stato un importante passo avanti nella lavorazione dei minerali. [11] Ha reso possibile lo sviluppo della gigantesca miniera di Bingham Canyon nello Utah. [12]
Nel ventesimo secolo, la maggior parte dei minerali veniva concentrata prima della fusione. La fusione è stata inizialmente effettuata utilizzando impianti di sinterizzazione e altiforni, [13] o con torrefattori e forni a riverbero. [14] La torrefazione e la fusione di forni a riverbero hanno dominato la produzione primaria di rame fino agli anni '60. [8]
Torrefazione
Il processo di tostatura viene generalmente eseguito in combinazione con forni a riverbero. Nella torrefazione, il concentrato di rame viene parzialmente ossidato per produrre “calcina” e gas di anidride solforosa. La stechiometria della reazione che si verifica è:
- 2 CuFeS 2 + 3 O 2 → 2 FeO + 2 CuS + 2 SO 2
La tostatura generalmente lascia più zolfo nel prodotto calcinato (15% nel caso della tostatrice delle Miniere del Monte Isa [15] ) rispetto a una pianta sinterizzata lascia nel prodotto sinterizzato (circa il 7% nel caso della fonderia di Raffinazione e Fusione elettrolitica [ 16] ).
A partire dal 2005, la tostatura non è più comune nel trattamento del concentrato di rame, perché la sua combinazione con forni a riverbero non è efficiente dal punto di vista energetico e la concentrazione di SO 2 nel gas di scarico della tostatura è troppo diluita per una cattura conveniente. [8] Ora è favorita la fusione diretta, ad esempio utilizzando le seguenti tecnologie di fusione: fusione rapida, forni Isasmelt, Noranda, Mitsubishi o El Teniente. [8]
Fusione

Sostituzione della fusione del forno a riverbero mediante fusione rapida, in relazione al numero di fonderie di rame che utilizzano questa tecnologia.
La fusione iniziale del materiale da fondere viene solitamente definita fase di fusione o fusione opaca . Può essere eseguita in una varietà di forni, compresi gli altiforni e i forni a riverbero in gran parte obsoleti, nonché i forni flash, i forni Isasmelt, ecc. [8] Il prodotto di questa fase di fusione è una miscela di rame, ferro e zolfo che è arricchito in rame, e che è chiamato opaco o rame opaco.[8] Il termine grado opaco è normalmente usato per riferirsi al contenuto di rame del mascherino. [17]
Lo scopo della fase di fusione opaca è eliminare il più possibile i minerali indesiderati di ferro, zolfo e ganga (come silice, magnesia, allumina e calcare), riducendo al minimo la perdita di rame. [17] Ciò si ottiene facendo reagire i solfuri di ferro con l'ossigeno (nell'aria o nell'aria arricchita di ossigeno) per produrre ossidi di ferro (principalmente come FeO, ma con un po' di magnetite (Fe 3O 4)) e anidride solforosa. [17]
Il solfuro di rame e l'ossido di ferro possono mescolarsi, ma quando viene aggiunta una quantità sufficiente di silice, si forma uno strato di scorie separato. [18] L'aggiunta di silice riduce anche il punto di fusione (o, più propriamente, la temperatura del liquidus) delle scorie, il che significa che il processo di fusione può essere operato a una temperatura più bassa. [18]
La reazione di formazione delle scorie è:
- FeO + SiO 2 → FeO.SiO 2[17]
La scoria è meno densa del mascherino, quindi forma uno strato che galleggia sopra il mascherino. [19]
Il rame può essere perso dal mascherino in tre modi: come ossido rameoso (Cu 2O) disciolto nella scoria, [20] come rame solfuro disciolto nella scoria [21] o come minuscole goccioline (o perline ) di mascherino sospese nel scorie. [22] [23]
La quantità di rame persa come ossido di rame aumenta all'aumentare del potenziale di ossigeno delle scorie. [23] Il potenziale di ossigeno generalmente aumenta all'aumentare del contenuto di rame del mascherino. [24] Pertanto la perdita di rame sotto forma di ossido aumenta all'aumentare del contenuto di rame del mascherino. [25]
D'altra parte, la solubilità del rame solfidrico nelle scorie diminuisce all'aumentare del contenuto di rame del mascherino oltre il 40% circa. [21] Nagamori calcolò che più della metà del rame disciolto nelle scorie di mascherine contenenti meno del 50% di rame è rame sulfidico. Al di sopra di questa cifra inizia a prevalere il rame ossidato. [21]
La perdita di rame come prill sospesi nella scoria dipende dalla dimensione dei prill, dalla viscosità della scoria e dal tempo di decantazione a disposizione. [26] Rosenqvist ha suggerito che circa la metà delle perdite di rame dovute alle scorie erano dovute a prill sospesi. [26]
La massa di scoria generata nella fase di fusione dipende dal contenuto di ferro del materiale immesso nel forno fusorio e dal grado di opaco target. Maggiore è il contenuto di ferro del mangime, più ferro dovrà essere scartato nelle scorie per un determinato grado opaco. Allo stesso modo, l'aumento del grado di mascherino target richiede il rigetto di più ferro e un aumento del volume delle scorie.
Pertanto, i due fattori che maggiormente influenzano la perdita di rame in scorie nella fase di fusione sono:
- grado opaco
- massa di scorie. [18]
Ciò significa che esiste un limite pratico su quanto può essere alto il grado opaco se si vuole ridurre al minimo la perdita di rame in scorie. Sono quindi necessarie ulteriori fasi di lavorazione (conversione e raffinazione a fuoco).
Le seguenti sottosezioni descrivono brevemente alcuni dei processi utilizzati nella fusione opaca.
Fusione del forno a riverbero
I forni a riverbero sono forni lunghi in grado di trattare concentrato umido, secco o tostato. [8] La maggior parte dei forni a riverbero utilizzati negli ultimi anni ha trattato il concentrato tostato perché l'immissione di materie prime per mangimi secchi nel forno a riverbero è più efficiente dal punto di vista energetico e perché l'eliminazione di parte dello zolfo nella tostatura si traduce in gradi più alti di matte. [8]
L'alimentazione del forno a riverbero viene aggiunta al forno attraverso fori di alimentazione lungo i lati del forno. [8] Normalmente si aggiunge ulteriore silice per aiutare a formare le scorie. Il forno viene acceso con bruciatori a carbone polverizzato, olio combustibile o gas naturale [27] e la carica solida viene fusa.
I forni a riverbero possono inoltre essere alimentati con scorie fuse dalla successiva fase di conversione per recuperare il rame contenuto e altri materiali ad alto contenuto di rame. [27]
Poiché il bagno del forno a riverbero è quiescente, si verifica pochissima ossidazione dell'alimentazione (e quindi viene eliminato pochissimo zolfo dal concentrato). È essenzialmente un processo di fusione. [26] Di conseguenza, i forni a riverbero a carica umida hanno meno rame nel loro prodotto opaco rispetto ai forni a carica di calcina e hanno anche perdite di rame inferiori alle scorie. [27] Gill cita un valore di rame nelle scorie dello 0,23% per un forno a riverbero caricato a umido rispetto allo 0,37% per un forno caricato con calcina. [27]
Nel caso dei forni a calcina, una parte significativa dello zolfo è stata eliminata durante la fase di tostatura e il calcinato è costituito da una miscela di ossidi e solfuri di rame e ferro. Il forno a riverbero agisce per consentire a queste specie di avvicinarsi all'equilibrio chimico alla temperatura di esercizio del forno (circa 1600 °C all'estremità del bruciatore e circa 1200 °C all'estremità della canna fumaria; [28] il mascherino è di circa 1100 °C e la scoria è di circa 1195 °C [27] ). In questo processo di equilibratura, l'ossigeno associato ai composti di rame si scambia con lo zolfo associato ai composti di ferro, aumentando il contenuto di ossido di ferro della fornace e gli ossidi di ferro interagiscono con la silice e altri materiali di ossido per formare le scorie. [27]
La principale reazione di equilibratura è:
- Cu 2O + FeS = Cu 2S + FeO [27]
La scoria e il mascherino formano strati distinti che possono essere rimossi dal forno come flussi separati. Lo strato di scorie viene periodicamente lasciato fluire attraverso un foro nella parete del forno sopra l'altezza dello strato opaco. Il mascherino viene rimosso drenandolo attraverso un foro in siviere per essere trasportato con una gru ai convertitori. [27] Questo processo di drenaggio è noto come spillatura del forno. [27] Il rubinetto opaco è normalmente un foro attraverso un blocco di rame raffreddato ad acqua che impedisce l'erosione dei mattoni refrattari che rivestono la fornace. Quando la rimozione del mascherino o delle scorie è completata, il foro viene normalmente tappato con argilla, che viene rimossa quando il forno è pronto per essere nuovamente spillato.
I forni a riverbero venivano spesso utilizzati per trattare le scorie fuse del convertitore per recuperare il rame contenuto. [27] Questo sarebbe stato versato nelle fornaci da siviere trasportate da gru. Tuttavia, la scoria del convertitore è ricca di magnetite [29] e parte di questa magnetite precipiterebbe dalle scorie del convertitore (a causa del suo punto di fusione più elevato), formando un accrescimento sul focolare del forno a riverbero e rendendo necessario lo spegnimento del forno per rimuovere l'accrescimento. [29] Questa formazione di accrescimento limita la quantità di scoria di conversione che può essere trattata in un forno a riverbero. [29]
Sebbene i forni a riverbero abbiano perdite di rame molto basse nelle scorie, non sono molto efficienti dal punto di vista energetico e le basse concentrazioni di anidride solforosa nei loro gas di scarico ne rendono antieconomica la cattura. [8] Di conseguenza, negli anni '70 e '80 gli operatori delle fonderie hanno dedicato molto denaro allo sviluppo di processi di fusione del rame nuovi e più efficienti. [30] Inoltre, le tecnologie di fusione rapida erano state sviluppate negli anni precedenti e iniziarono a sostituire i forni a riverbero. Nel 2002, 20 dei 30 forni a riverbero ancora in funzione nel 1994 erano stati chiusi. [8]
Fusione in forno flash
Nella fusione rapida, il concentrato viene disperso in un flusso di aria o ossigeno e le reazioni di fusione sono in gran parte completate mentre le particelle minerali sono ancora in volo. [30] Le particelle reagite si depositano quindi in un bagno sul fondo del forno, dove si comportano come la calcina in un forno a riverbero. [31] Uno strato di scorie si forma sopra lo strato opaco e possono essere spillati separatamente dal forno. [31]
Conversione

Rame privo di ossigeno, noto anche come rame "Tough-pitch" (puro al 98% circa), contenente antimonio e nichel
Il mascherino, che viene prodotto nella fonderia, contiene il 30-70% di rame (a seconda del processo utilizzato e della filosofia operativa della fonderia), principalmente come solfuro di rame e solfuro di ferro. Lo zolfo viene rimosso ad alta temperatura come anidride solforosa soffiando aria attraverso il mascherino fuso:
- 2 CuS + 3 O 2 → 2 CuO + 2 SO 2
- CuS + O 2 → Cu + SO 2
In una reazione parallela il solfuro di ferro viene convertito in scoria:
- 2 FeS + 3 O 2 → 2 FeO + 2 SO 2
- 2 FeO + SiO 2 → Fe 2SiO 4
La purezza di questo prodotto è del 98%, è noto come blister a causa della superficie rotta creata dalla fuoriuscita del gas di anidride solforosa durante il raffreddamento dei maiali o dei lingotti di rame blister. I sottoprodotti generati nel processo sono anidride solforosa e scorie. L'anidride solforosa viene catturata per essere utilizzata nei processi di lisciviazione precedenti.
Raffinazione del fuoco
Il rame blister viene messo in un forno anodico, un forno che raffina il rame blister in rame di grado anodo in due fasi rimuovendo la maggior parte dello zolfo e del ferro rimanenti e quindi rimuovendo l'ossigeno introdotto durante la prima fase. Questa seconda fase, spesso indicata come polarizzazione , viene eseguita soffiando gas naturale, o qualche altro agente riducente, attraverso l'ossido di rame fuso. Quando questa fiamma diventa verde, indicando lo spettro di ossidazione del rame, l'ossigeno è stato per lo più bruciato. Questo crea rame a circa il 99% di purezza.
Elettroraffinazione

Apparecchio per la raffinazione elettrolitica del rame
Il rame viene raffinato mediante elettrolisi. Gli anodi fusi dal rame blister lavorato vengono posti in una soluzione acquosa di 3–4% di solfato di rame e 10–16% di acido solforico. I catodi sono fogli laminati sottili di rame altamente puro o, più comunemente oggigiorno, fogli di partenza in acciaio inossidabile riutilizzabili (come nel processo IsaKidd). [32] Per avviare il processo è necessario un potenziale di soli 0,2–0,4 volt. Negli impianti industriali sono possibili densità di corrente fino a 420 A/m 2 . [33] All'anodo si dissolvono rame e metalli meno nobili. Metalli più nobili come argento, oro, selenio e tellurio si depositano sul fondo della cella come melma anodica, che forma un sottoprodotto vendibile. Gli ioni rame(II) migrano attraverso l'elettrolita al catodo. Al catodo, le piastre metalliche di rame escono, ma i costituenti meno nobili come l'arsenico e lo zinco rimangono in soluzione a meno che non venga utilizzata una tensione più elevata. [34] Le reazioni sono:
All'anodo: Cu (s) → Cu 2+ (aq) + 2e −
Al catodo: Cu 2+ (aq) + 2e − → Cu (s)
Marketing concentrato e rame
I concentrati di rame prodotti dalle miniere vengono venduti a fonderie e raffinerie che trattano il minerale e raffinano il rame e addebitano questo servizio tramite tariffe di trattamento (TC) e tariffe di raffinazione (RC). Il mercato globale dei concentrati di rame [35] è stato valutato a 81 miliardi di dollari nel 2019 e si prevede che raggiungerà i 93 miliardi di dollari entro il 2027, espandendosi a un CAGR del 2,5%. I TC vengono addebitati in dollari USA per tonnellata di concentrato trattato e gli RC vengono addebitati in centesimi per libbra trattata, denominati in dollari USA, con prezzi di riferimento fissati annualmente dalle principali fonderie giapponesi. Il cliente in questo caso può essere una fonderia, che vende lingotti di rame blister a una raffineria, o una fonderia-raffineria integrata verticalmente.
Una forma prevalente di concentrato di rame contiene oro e argento, come quella prodotta dalla Bougainville Copper Limited dalla miniera di Panguna dall'inizio degli anni '70 alla fine degli anni '80.
Il contratto tipico per un minatore è denominato contro il prezzo del London Metal Exchange, meno i TC-RC e tutte le penali o crediti applicabili. Le sanzioni possono essere valutate nei confronti dei concentrati di rame in base al livello di elementi dannosi come arsenico, bismuto, piombo o tungsteno. Poiché gran parte dei corpi di minerali di solfuro di rame contengono argento o oro in quantità apprezzabili, è possibile pagare un credito al minatore per questi metalli se la loro concentrazione all'interno del concentrato è superiore a un determinato importo. Di solito il raffinatore o la fonderia addebita al minatore una commissione in base alla concentrazione; un contratto tipico specificherà che è dovuto un credito per ogni oncia di metallo nel concentrato al di sopra di una certa concentrazione; al di sotto di ciò, se viene recuperato, la fonderia manterrà il metallo e lo venderà per coprire i costi.
Il concentrato di rame viene scambiato tramite contratti spot o contratti a lungo termine come prodotto intermedio a sé stante. Spesso la fonderia vende il rame metallico stesso per conto del minatore. Al minatore viene pagato il prezzo nel momento in cui la fonderia-raffineria effettua la vendita, non al prezzo alla data di consegna del concentrato. In un sistema di quotazione preventiva, il prezzo è concordato in una data futura fissa, in genere 90 giorni dal momento della consegna allo smelter.
Il catodo di rame di grado A è composto per il 99,99% di rame in fogli di 1 cm di spessore e di circa 1 metro quadrato del peso di circa 200 libbre. È una vera merce, consegnabile e negoziabile sulle borse dei metalli di New York City (COMEX), Londra (London Metals Exchange) e Shanghai (Shanghai Futures Exchange). Spesso il catodo di rame viene scambiato sulle borse indirettamente tramite warrant, opzioni o contratti di swap in modo tale che la maggior parte del rame venga scambiata su LME/COMEX/SFE ma la consegna avvenga direttamente, spostando logisticamente il rame fisico e trasferendo il foglio di rame da i magazzini fisici stessi.
La specifica chimica per il rame di grado elettrolitico è ASTM B 115-00 (uno standard che specifica la purezza e la resistività elettrica massima del prodotto).
Mr. Nick Sun [email protected]
Orario di pubblicazione: 27 settembre 2020
